一类医疗器械备案
- 服务详情

1、申请条件(进口、国产都适用)
(1)属于第一类医疗器械产品目录的产品(2014年第8号通告附件或已通过国家局分类界定后属于第一类医疗器械的产品(已录入国家局审批系统);(2)办理第一类医疗器械备案申请事务的人员应当受生产企业委托,并具有相应的专业知识,熟悉医疗器械注册、备案相关的法律、法规、规章和技术要求;
(3)申请备案的第一类医疗器械,产品技术要求需符合{国家食品药品监督管理总局关于发布医疗器械产品技术要求编写指导原则的通告(第9号)};
(4)资料要求需符合(国家食品药品监督管理总局关于第一类医疗器械备案有关事项的公告)(第26号)的备案资料形式要求。
2、一类医疗器械备案变更
已备案的医疗器械,备案信息表中登载内容及备案的产品技术要求发生变化的,备案人应当提交变化情况的说明及相关证明文件,向原备案部门提出变更备案信息。备案资料符合形式要求的,食品药品监督管理部门应当将变更情况登载于变更信息中,将备案资料存档。
已备案的医疗器械管理类别调整的,备案人应当主动向食品药品监督管理部门提出取消原备案;管理类别调整为第二类或者第三类医疗器械的,按照本办法规定申请注册。
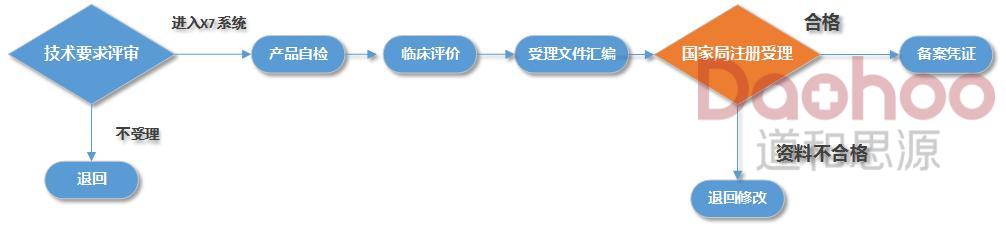
一类产品备案保过体系和X7省时系统
一类产品备案资料的收集和评估
一类产品备案资料的撰写和符合
一类产品备案资料的递交
一类产品生产场地的备案
我们的服务优势

医疗器械合规上市,我们更快
快速响应、专业系统、快速行动、高效上市,道和思源首创的X7提速体系,使每个项目平均省时60天。

道和思源历史通过率100%
在全球服务的100+项目中,通过率100%。选择我们,就等于选择了竞争优势。

全程168步省心服务优化
关于于医疗器械合规上市相关法规、政策,我们更专业。关于合规上市的客户服务,我们更用心。
6、一类医疗器械备案服务流程