第二类医疗器械注册变更要求有哪些?
2014年9月11日,国家食品药品监督管理总局以食药监械管〔2014〕209号印发《境内第二类医疗器械注册审批操作规范》。该分境内第二类医疗器械注册审批、登记事项变更、其他要求3部分。
一、注册变更
注册变更分为登记事项变更和许可事项变更。
二、登记事项变更
1. 注册证中注册人名称和住所、代理人名称和住所发生变化。
2. 境内医疗器械生产地址发生变化。
三、许可事项变更
1. 注册证及其附件载明的产品名称、型号、规格发生变化。
对于新增强制性标准,仅新增型号需要符合新的强制性标准的要求并提交检验报告,并在产品技术要求中对新的强制性标准的内容注明仅新增的**型号适用,不在产品技术要求中增加原有型号符合新强制性标准的内容。许可事项变更注册申请人应确保,自新的强制性标准实施之日起,原有型号也能够满足新标准的要求。如果需要在产品技术要求中增加原有型号满足新强制性标准要求的内容,还应提交原有型号符合新强制性标准的检测报告。
产品变更注册增加规格型号,对强制性标准中要求提交人体评估资料的产品未提交相关的研究资料。
2. 结构及组成发生变化。
有源产品许可事项变更注册时电气元件不发生变化,发生其他变化,需对申报变更产品的变化情况进行整体评估,如外壳构造改变、设备整体密封性能改变等,变化部分如不涉及电气安全标准或电磁兼容标准的要求,则无需另行检测;如变化部分涉及电气连接、影响电气安全标准/电磁兼容标准要求,需重新判定或评估,对变更部分涉及的性能指标应一并进行检测。
有源产品许可事项变更注册时产品关键元器件发生变化,变化部分仅涉及元器件的供应商或者生产厂家,性能参数未发生变化,对于未在注册证及其附件载明的内容发生变化的,企业应按照其自身质量管理体系要求做好相关工作,并保证其质量管理体系的持续有效运行。
产品增加配件,个别申请人仅对安规性能进行检测,未就电磁兼容性进行检测。
3.产品技术要求发生变化。
申请人应提交注册产品标准更改单,不能直接通过注册变更申请将注册产品标准转换为产品技术要求,经注册许可发放的变更批件与原证、原产品标准配合使用。产品技术要求在产品延续注册批准后配发。
4.产品适用范围发生变化。
产品增加新的功能参数,申请人按照“产品技术要求变更”提出许可事项变更申请,申请人未就新的功能参数提供相关的研究资料,新增功能参数后产品适用范围变化的必须提供临床评价资料。例如多参数监护仪产品增加新的功能参数,应分析并说明变化部分对产品安全性、有效性的影响,如果新增的功能参数与免临床目录内产品具有等同性,可按照临床评价相关要求予以评价;如果新增的功能参数的监护仪具有同品种医疗器械,可采取临床评价的方式予以评价;如果新增功能参数的监护仪无法通过上述方式进行临床评价,应考虑进行临床试验,以确认产品使用范围。
四、注册变更流程
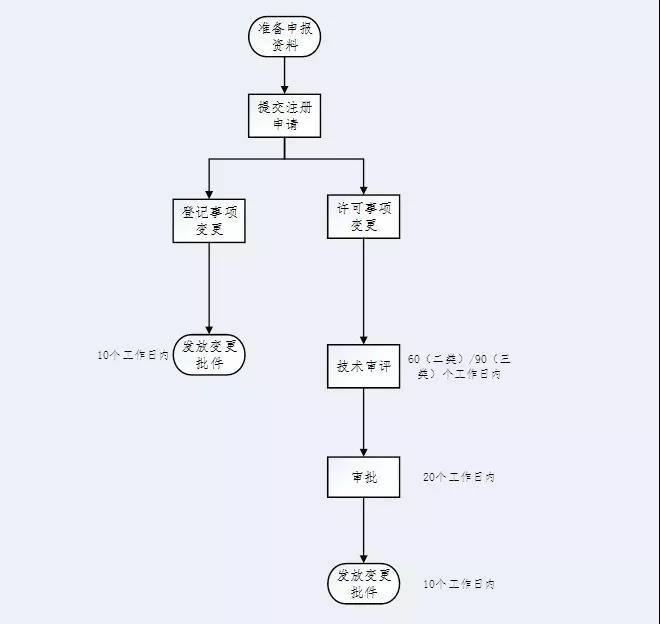
五、本文所涉及的法规文件
(一)《医疗器械监督管理条例》(国务院令第650号)
修订日期:2014年2月12日国务院第39次常务会议修订通过,2014年6月1日施行;2017年5月4日第二次修订。
施行日期:2017年5月19日公布并施行。
(二)《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)
发布日期:2014年7月30日
施行日期:2014年10月1日
(三)《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)
发布日期:2015年12月21日
施行日期:2016年4月1日
(四)《国家食品药品监督管理总局关于发布医疗器械产品技术要求编写指导原则的通告》(第9号)
发布日期:2014年5月30日
注:
道和思源(北京)科技有限公司是一家专门做医疗器械注册服务的公司,服务项目医疗器械注册、医疗器械注册变更、医疗器械延续注册、临床试验、质量体系等等,如果您想做医疗器械注册欢迎前来咨询。
