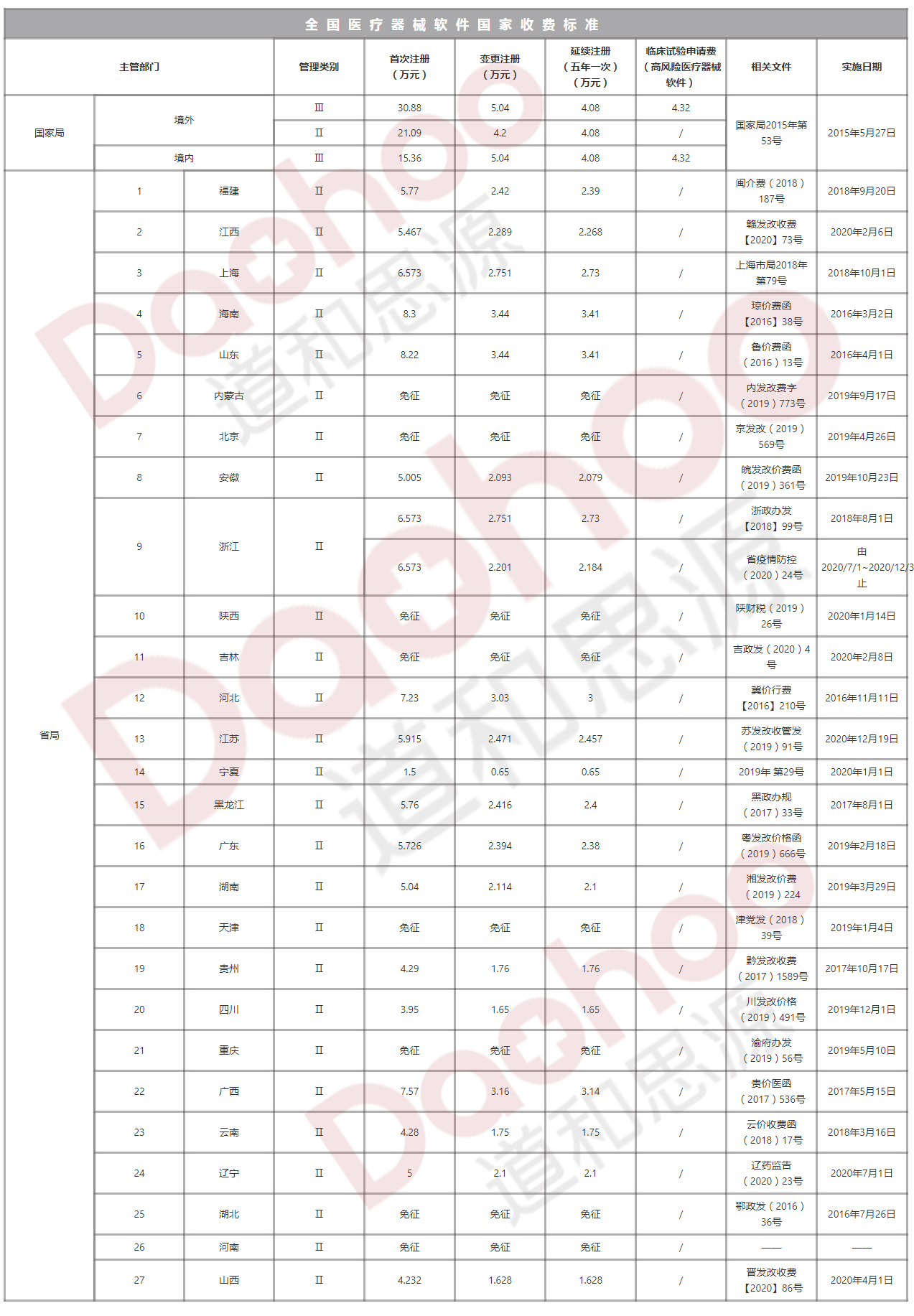
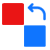
《医疗器械注册管理办法》规定,注册人名称和住所、代理人名称和住所发生变化的,注册人应当向原注册部门申请登记事项变更;境内医疗器械生产地址变更的,注册人应当在相应的生产许可变更后办理注册登记事项变更。登记事项变更资料符合要求的,食品药品监督管理部门应当在10个工作日内发给医疗器械注册变更文件。登记事项变更资料不齐全或者不符合形式审查要求的,食品药品监督管理部门应当一次告知需要补正的全部内容。1、设定...
《医疗器械注册管理办法》规定,注册人名称和住所、代理人名称和住所发生变化的,注册人应当向原注册部门申请登记事项变更;境内医疗器械生产地址变更的,注册人应当在相应的生产许可变更后办理注册登记事项变更。登记事项变更资料符合要求的,食品药品监督管理部门应当在10个工作日内发给医疗器械注册变更文件。登记事项变更资料不齐全或者不符合形式审查要求的,食品药品监督管理部门应当一次告知需要补正的全部内容。
1.《医疗器械监督管理条例》(国务院令 第680号)第十四条:“已注册的第二类、第三类医疗器械产品,其设计、原材料、生产工艺、适用范围、使用方法等发生实质性变化,有可能影响该医疗器械安全、有效的,注册人应当向原注册部门申请办理变更注册手续;发生非实质性变化,不影响该医疗器械安全、有效的,应当将变化情况向原注册部门备案。”
2.《医疗器械注册管理办法》(国家食品药品监督管理总局令 第4号)第四十九条:“已注册的第二类、第三类医疗器械,医疗器械注册证及其附件载明的内容发生变化,注册人应当向原注册部门申请注册变更,并按照相关要求提交申报资料。注册人名称和住所、代理人名称和住所发生变化的,注册人应当向原注册部门申请登记事项变更;境内医疗器械生产地址变更的,注册人应当在相应的生产许可变更后办理注册登记事项变更。”第五十条:“登记事项变更资料符合要求的,食品药品监督管理部门应当在10个工作日内发给医疗器械注册变更文件。登记事项变更资料不齐全或者不符合形式审查要求的,食品药品监督管理部门应当一次告知需要补正的全部内容。”
3.关于公布医疗器械注册申报资料要求和批准证明文件格式的公告(国家食品药品监督管理总局公告 2014年 第43号 )附件6:医疗器械注册变更申报资料要求及说明登记事项变更申报资料要求及说明。
1.申请表
2.证明性文件
3.注册人关于变更情况的声明
4.原医疗器械注册证及其附件复印件、历次医疗器械注册变更文件复印件
5.关于变更情况相关的申报资料关于变更情况相关的申报资料要求
6.符合性声明
1.法定办结时限说明
受理5个工作日,登记事项变更资料符合要求的,食品药品监督管理部门应当在10个工作日内发给医疗器械注册变更文件。
2.承诺办结时限说明
受理5个工作日,登记事项变更资料符合要求的,食品药品监督管理部门应当在10个工作日内发给医疗器械注册变更文件。
1.受理
申请人向国家药品监督管理局行政受理服务大厅提出申请,受理人员根据申报事项按照《国家食品药品监督管理总局关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2014年第43号)、《食品药品监管总局关于印发境内第三类和进口医疗器械注册审批操作规范》(食药监械管〔2014〕208号)的要求对申报资料进行形式审查。
申请事项属于本部门职权范围,申报资料齐全、符合形式审查要求的,予以受理;申报资料存在可以当场更正的错误的,允许申请人当场更正;申报资料不齐全或者不符合形式审查要求的,在5个工作日内一次告知申请人需要补正的全部内容,逾期不告知的,自收到申报资料之日起即为受理;申请事项不属于本部门职权范围的,即时告知申请人不予受理。
2.送达
受理之日起10个工作日内,国家药品监督管理局行政事项受理服务和投诉举报中心将医疗器械注册变更文件送达申请人。
不收费
答: 依据《境内第三类和进口医疗器械注册审批操作规范》(食药监械管[2014]208号)的要求,进口产品申报资料,如无特别说明,原文资料均应由申请人签章,中文资料由代理人签章。原文资料“签章”是指:申请人法定代表人或者负责人签名,或者签名并加盖组织机构印章,并且应当提交由申请人所在地公证机构出具的公证件。